Strukturuntersuchungen von Auxin-Phytohormonen.
 |
English Version. | |
| © |
Copyright-Hinweise. | |
 |
Übersicht. |
Strukturuntersuchungen von Auxin-Phytohormonen. |
|
| T1 | T2 | E [kJ/mol] |
|---|---|---|
| 92,85° | 106,96° | 0,000 |
| 0,00° | 0,00° | 0,881 |
| 104,57° | 3,10° | 1,887 |
| 79,64° | -97,97° | 2,452 |
| 15,73° | 113,04° | 7,510 |
Die Potenzialfläche von 4-Methyl-indol-3-essigsäure (4-Me-IAA) enthält fünf symmetrie-eindeutige Konformere (A, B, ..., E), deren Geometrien nach diesem Absatz in der Reihenfolge ihrer Energie abgebildet sind. Die T1/T2-Werte und die relativen Energien sind in der Tabelle zusammengefasst.
Ähnlich wie bei 4-Et-IAA ist das globale Minimum A nicht spiegelsymmetrisch, sondern hat die Essigsäureseitenkette gewinkelt zum Indolring. Das Carbonylsauerstoffatom kommt dadurch einem der Wasserstoffatome der Methylgruppe nahe genug, um eine Wasserstoffbrücke auszubilden (Distanz: 2,575 Å, Bindungsordnung: 0,018), die schwächer ist als ihr Gegenstück im globalen Minimum von 4-Et-IAA. Das spiegelsymmetrische Konformer B enthält eine andere Wasserstoffbrücke C-H···O=C von ähnlicher Stärke (2,329 Å, Bindungsordnung 0,018), zugleich aber auch zwei repulsive H···H-Wechselwirkungen zwischen der Methylgruppe und der Essigsäureseitenkette (Abstände: 2,405 Å). Auch alle anderen Konformere weisen schwache intramolekulare Wechselwirkungen auf: in C liegt eine ähnliche Wechselwirkung wie in A vor, die aber zu lang (2,767 Å) ist um Wasserstoffbrückencharakter aufweisen zu können, in D bildet sich eine ganz schwache Wasserstoffbrücke C-H···O zwischen Methylgruppe und Hydroxylsauerstoffatom aus (Distanz: 2,635 Å, Bindungsordnung 0,011), und E enthält eine Wasserstoffbrücke C-H···O zwischen der OH-Gruppe und dem Indolkern mit einem O···H-Abstand von 2,563 Å und einer Bindungsordnung von 0,012.
Während die T1/T2-Werte von einigen Konformeren stimmen gut mit denen von
unsubstituierter Indolessigsäure
übereinstimmen, stimmen andere gut mit denen von
4-Cl-IAA überein.
Das gleich gilt für die Reaktionswege, wo 4-Me-IAA Charakteristika von
beiden Potenzialflächen (IAA und 4-Cl-IAA) aufweist.
In einem qualitativen Sinn liegt 4-Me-IAA daher zwischen IAA und 4-Cl-IAA,
was in den biologischen Aktivitätsdaten ein faszinierendes
Gegenstück hat: Rescher et al. haben die Korrelation zwischen
Auxinbindungsaffinität und maximaler Wachstumsrate bei Maiskeimlingen
untersucht und bei der optimalen Konzentration von 10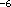 mol/l
folgende Reihenfolge gefunden: Naphthalen-1-essigsäure > 4-Cl-IAA >
4-Me-IAA > IAA > 4-Et-IAA > 2-Me-IAA.
In dieser Reihenfolge nimmt 4-Me-IAA ebenfalls eine Position zwischen
IAA und 4-Cl-IAA ein, obwohl das natürlich zum Teil durch die
höhere Lipophilizität der chlorierten Verbindung verursacht sein kann.
mol/l
folgende Reihenfolge gefunden: Naphthalen-1-essigsäure > 4-Cl-IAA >
4-Me-IAA > IAA > 4-Et-IAA > 2-Me-IAA.
In dieser Reihenfolge nimmt 4-Me-IAA ebenfalls eine Position zwischen
IAA und 4-Cl-IAA ein, obwohl das natürlich zum Teil durch die
höhere Lipophilizität der chlorierten Verbindung verursacht sein kann.