Strukturuntersuchungen von Auxin-Phytohormonen.
 |
English version. |
| © |
Copyright-Hinweise. |
 |
Übersicht. |
Strukturuntersuchungen von Auxin-Phytohormonen. |
|
Die Ergebnisse für die verschiedenen Derivate der 3-Indolessigsäure (IAA) zeigen, dass die Form der Energiehyperfläche entscheidend von den Substituenten an Position 4 abhängt. Besonders bemerkenswert ist die Serie 4-Cl-IAA, 4-Me-IAA und IAA: während die Potenzialflächen von IAA und 4-Cl-IAA ganz unterschiedlich sind, ist jene von 4-Me-IAA irgendwo dazwischen angesiedelt, denn sie enthält Elemente von beiden Extremfällen. Es war daher nahe liegend, diese Serie in einer geeigneten Weise zu erweitern. Da der kombinierte sterische und elektronische Einfluss des Chloratoms in 4-Cl-IAA die Bewegungsmöglichkeiten der Seitenkette sehr effektiv einschränkt, war das andere Ende der Serie der logische Ansatzpunkt: Ändern des C-H-Fragmentes in ein Stickstoffatom sollte den sterischen Einfluss auf ein Minimum reduzieren.
| T1 | T2 | E [kJ/mol] |
|---|---|---|
| 0,00° | 0,00° | 0,000 |
| 100,85° | -15,68° | 5,611 |
| 47,71° | 115,07° | 8,112 |
| 114,84° | 145,56° | 8,648 |
1-H-Pyrrolo[3,2-b]pyridin-3-ylessigsäure (PPAA) ist die so konstruierte Erweiterung der Serie 4-Cl-IAA, 4-Me-IAA und IAA; die planaren Formen all dieser Moleküe sind über diesem Absatz zusammengefasst. Die Energiehyperfläche von PPAA enthält vier symmetrie-eindeutige Minima mit cis-Orientierung der COOH-Gruppe, K, L, M und N, deren 6-31G* optimierte Daten in der Tabelle angegeben sind. Die Geometrien dieser Konformere entsprechen jenen der 4-Cl-IAA Energieminima, außer dass M wegen einer attraktiven C-H···N-Wechselwirkung (H···N-Distanz 2,736 Å) zu einem höheren T1-Wert verschoben ist. Die relativen Energien unterscheiden sich jedoch: B und C sind in der Energiefläche von 4-Cl-IAA stabiler als ihre Analoga L und N, wohingegen das kinetisch instabile 4-Cl-IAA-Konformer D seine Entsprechung in M findet, das durch die oben genannte anziehende intramolekulare Wechselwirkung stabilisiert wird.
Diese Minima sind untereinander und mit ihren Spiegelbildern l, m und n durch ein Netzwerk von Reaktionswegen verbunden, das jenem von 4-Cl-IAA sehr ähnlich ist. Der Hauptunterschied ist die Konformation mit T1=0° und T2=180°, die im 4-Cl-Fall ein Sattelpunkt (D-d), hier jedoch ein Sattelpunkt zweiter Ordnung ist. Die Geometrien dieser beiden Konformationen sind neben diesem Absatz wiedergegeben; sie zeigen, dass eine Kombination von elektronischem und sterischem Einfluss für diesen Unterschied verantwortlich ist: in 4-Cl-IAA ist die Torsion der Seitenkette sterisch gehindert, während sie in PPAA zu einer verstärkten N···H-C-Wechselwirkung führt.
PPAA bildet weiters ein Konformer, in dem die
COOH-Gruppe in der
trans-Orientierung vorliegt und eine intramolekulare
N···H-O-Wasserstoffbrücke ausbildet.
Zwei Ansichten dieses Konformeren sind neben diesem Absatz gezeigt.
Dieses wasserstoffbrückengebundene Konformer ist von beträchtlicher
Stabilität: es hat eine relative Energie von 5,802 kJ/mol und
eine Potenzialbarriere von 42,505 kJ/mol in der Reaktion zu
N; die N···H-Distanz beträgt
2.020 Å, die Bindungsordnung N···H
0.069. Die Wasserstoffbrücke ist in ihrer Stärke also derjenigen in
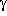 -Aminobuttersäure vergleichbar,
die ebenfalls zu einem siebengliedrigen Ring führt.
-Aminobuttersäure vergleichbar,
die ebenfalls zu einem siebengliedrigen Ring führt.