| Die intramolekulare Wasserstoffbrücke in
Glycin. |

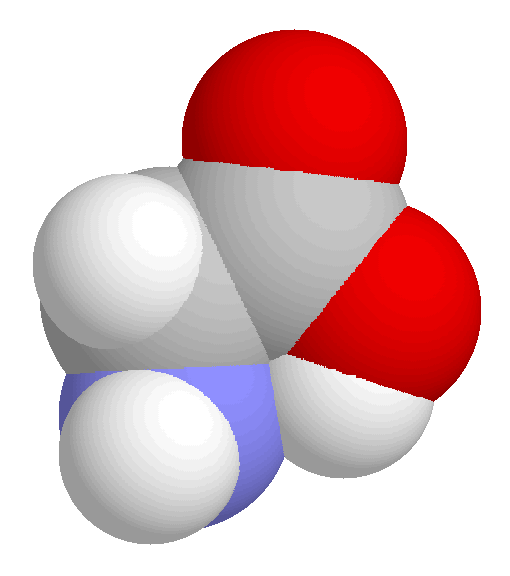
-
Elektronendichte und Kalottenmodell
des wasserstoffbrückengebundenen Glycin-Konformers.
-
Die Elektronendichte (6-31G*) ist für einen Schnitt durch die
Spiegelebene des Moleküls gezeigt; Die Farbcodierung
wechselt bei 0.01, 0.02, ..., 0.10, 0.15, 0.20, ..., 0.60, 0.85, 1.10, ...,
3.10 und 5.00 Elektronen/Bohr³.
Schön zu sehen sind die Sattelpunkte der Elektronendichte, die ein
Kriterium für das Vorliegen einer chemischen Bindung sind (
 "What
is a bond?", R. F. W. Bader).
Die Werte der Dichte in diesen
Punkten sind ein Maß für die Stärke der entsprechenden
Bindung. Die Wasserstoffbrücke ist demnach eine echte chemische
Bindung mit einer Stärke von einigen Prozent einer Einfachbindung;
im Kalottenmodell führt sie zu einer deutlichen
Überlappung der entsprechenden Kalotten.
Gut zu erkennen ist in der Elektronendichtedarstellung auch die Polarisation
im Bereich des Stickstoffatoms als Folge der intramolekularen
Wasserstoffbrücke.
"What
is a bond?", R. F. W. Bader).
Die Werte der Dichte in diesen
Punkten sind ein Maß für die Stärke der entsprechenden
Bindung. Die Wasserstoffbrücke ist demnach eine echte chemische
Bindung mit einer Stärke von einigen Prozent einer Einfachbindung;
im Kalottenmodell führt sie zu einer deutlichen
Überlappung der entsprechenden Kalotten.
Gut zu erkennen ist in der Elektronendichtedarstellung auch die Polarisation
im Bereich des Stickstoffatoms als Folge der intramolekularen
Wasserstoffbrücke.

 Glycin.
Glycin.
 Anfang der Wasserstoffbrücken-Tour.
Anfang der Wasserstoffbrücken-Tour.
 Arbeitsbereich Quantenchemie.
Arbeitsbereich Quantenchemie.
Offenlegung gem. §25 MedienG: Dr. Michael Ramek, Graz.

