Intramolekulare Wasserstoffbrücken in Aminoaldehyden.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Aminoaldehyden. |
|
 Die Auswertung aller intramolekularen Wechselwirkungen in
3-Aminopropanal,
Die Auswertung aller intramolekularen Wechselwirkungen in
3-Aminopropanal,  -Alanin
und 3-Aminopropanol zeigt, dass die Wasserstoffbrücke
N···H-O die stärkste dieser Wechselwirkungen ist.
Daher sind auch alle Konformere, in denen diese
N···H-O-Brücke auftritt,
kinetisch sehr stabil: die kleinste Potenzialbarriere beträgt
28,66 kJ/mol
-Alanin
und 3-Aminopropanol zeigt, dass die Wasserstoffbrücke
N···H-O die stärkste dieser Wechselwirkungen ist.
Daher sind auch alle Konformere, in denen diese
N···H-O-Brücke auftritt,
kinetisch sehr stabil: die kleinste Potenzialbarriere beträgt
28,66 kJ/mol ![]()
 -Alanin)
-Alanin)
 Die Erwartung,
dass diese stärkste Wechselwirkung auch den größten
Einfluss auf die Potenzialflächen hat, ist jedoch irreführend.
Das zeigen bereits die Geometrien der Konformere, die
diese N···H-O-Brücke enthalten, wie auf
der vorangegangenen Seite dieser Tour diskutiert wurde.
Vielmehr kann der Schluss gezogen werden, dass die CO-Gruppe
die jeweilige Potenzialfäche am meisten beeinflusst;
zu diesem Schluss kommt man auch durch Vergleich
zwischen den homologen
Die Erwartung,
dass diese stärkste Wechselwirkung auch den größten
Einfluss auf die Potenzialflächen hat, ist jedoch irreführend.
Das zeigen bereits die Geometrien der Konformere, die
diese N···H-O-Brücke enthalten, wie auf
der vorangegangenen Seite dieser Tour diskutiert wurde.
Vielmehr kann der Schluss gezogen werden, dass die CO-Gruppe
die jeweilige Potenzialfäche am meisten beeinflusst;
zu diesem Schluss kommt man auch durch Vergleich
zwischen den homologen  -Aminosäuren und
-Aminosäuren und  -Aminoalkoholen. Die große Ähnlichkeit
von 3-Aminopropanal und
-Aminoalkoholen. Die große Ähnlichkeit
von 3-Aminopropanal und  -Alanin wird dadurch leicht verständlich; diese
Ähnlichkeit findet sich
nicht nur in den Eigenschaften der globalen Minima, sondern auch in den
Geometrien und Energien aller anderen Konformere.
Für das
-Alanin wird dadurch leicht verständlich; diese
Ähnlichkeit findet sich
nicht nur in den Eigenschaften der globalen Minima, sondern auch in den
Geometrien und Energien aller anderen Konformere.
Für das  -Alanin-Konformer mit der attraktiven
N···H-O-Brücke ist sie
besonders spektakulär, denn das entsprechende Konformer von
3-Aminopropanal enthält eine elektronisch repulsive Wechselwirkung
(was z.B. dazu führt, dass diese
beiden Konformere ganz verschiedene
Reaktionswege für die Drehung der -CO(R)-Gruppe haben).
-Alanin-Konformer mit der attraktiven
N···H-O-Brücke ist sie
besonders spektakulär, denn das entsprechende Konformer von
3-Aminopropanal enthält eine elektronisch repulsive Wechselwirkung
(was z.B. dazu führt, dass diese
beiden Konformere ganz verschiedene
Reaktionswege für die Drehung der -CO(R)-Gruppe haben).
 Der Schluss, dass die CO-Gruppe den Haupteinfluss ausübt, wird auch
durch die Beobachtung unterstützt, dass die Torsion der OH-Gruppe in
3-Aminopropanol (so wie in anderen Alkoholen auch) drei Energieminima
pro voller Umdrehung aufweist, in
Der Schluss, dass die CO-Gruppe den Haupteinfluss ausübt, wird auch
durch die Beobachtung unterstützt, dass die Torsion der OH-Gruppe in
3-Aminopropanol (so wie in anderen Alkoholen auch) drei Energieminima
pro voller Umdrehung aufweist, in 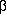 -Alanin (oder anderen organischen
Säuren) wegen der starken elektrostatischen C=O/O-H-Wechselwirkung
aber nur zwei.
-Alanin (oder anderen organischen
Säuren) wegen der starken elektrostatischen C=O/O-H-Wechselwirkung
aber nur zwei.