Intramolekulare Wasserstoffbrücken in Aminosäuren.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Aminosäuren. |
|
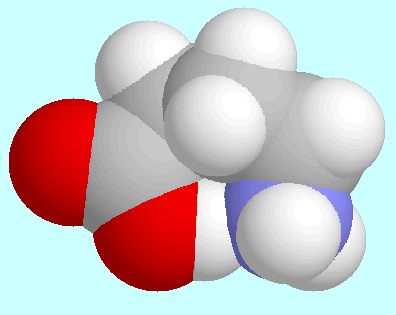 Alle
Alle  -Aminosäuren können eine intramolekulare
N···H-O Wasserstoffbrücke zwischen den
beiden Endgruppen -COOH und -NH
-Aminosäuren können eine intramolekulare
N···H-O Wasserstoffbrücke zwischen den
beiden Endgruppen -COOH und -NH ausbilden.
Bis zu
ausbilden.
Bis zu  -Aminopentansäure kann
diese nur gebildet werden, wenn die COOH-Gruppe in der energetisch
ungünstigeren trans-Orientierung vorliegt, sodass keines
dieser Konformere das globale Minimum der jeweiligen Potenzialfläche ist.
-Aminopentansäure kann
diese nur gebildet werden, wenn die COOH-Gruppe in der energetisch
ungünstigeren trans-Orientierung vorliegt, sodass keines
dieser Konformere das globale Minimum der jeweiligen Potenzialfläche ist.
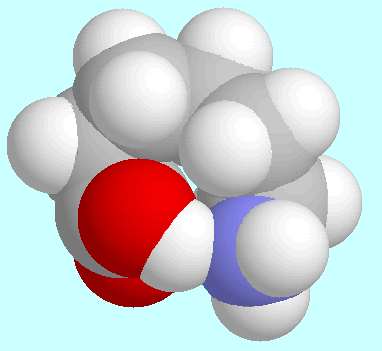 Die Stärke der Wasserstoffbrückenbindung zeigt eine stetige Zunahme
bis zu
Die Stärke der Wasserstoffbrückenbindung zeigt eine stetige Zunahme
bis zu 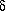 -Aminopentansäure, in
der diese Bindung einen achtgliedrigen Ring schließt.
In
-Aminopentansäure, in
der diese Bindung einen achtgliedrigen Ring schließt.
In  -Aminohexansäure ist
die Wasserstoffbrückenbindung
auf Grund von sterischen Problemen wieder schwächer, aber es gibt
mehrere Konformere, in denen die COOH-Gruppe in einer verzerrten
cis-Orientation auftritt. Es kann daher erwartet werden, dass
zeta-Aminoheptansäure die Bildung eines durch eine Wasserstoffbrücke
geschlossenen zehngliedrigen Ringes erlaubt, in dem die COOH-Gruppe in
einer stabilen, unverzerrten cis-Orientation vorliegt.
-Aminohexansäure ist
die Wasserstoffbrückenbindung
auf Grund von sterischen Problemen wieder schwächer, aber es gibt
mehrere Konformere, in denen die COOH-Gruppe in einer verzerrten
cis-Orientation auftritt. Es kann daher erwartet werden, dass
zeta-Aminoheptansäure die Bildung eines durch eine Wasserstoffbrücke
geschlossenen zehngliedrigen Ringes erlaubt, in dem die COOH-Gruppe in
einer stabilen, unverzerrten cis-Orientation vorliegt.
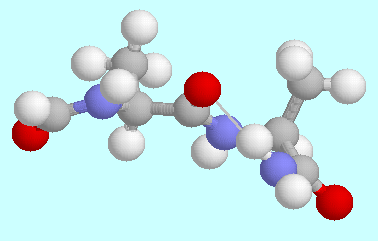 Die Erkenntnis, dass es eines zehngliedrigen
Ringes bedarf, um eine Wasserstoffbrücke zu schließen
ohne den Nachteil einer ungünstigen Orientierung in
einem Teil des Ringes in Kauf nehmen zu müssen, gibt einen
schönen Einblick in die Peptid-
und Proteinchemie. Peptide und Proteine werden durch
Die Erkenntnis, dass es eines zehngliedrigen
Ringes bedarf, um eine Wasserstoffbrücke zu schließen
ohne den Nachteil einer ungünstigen Orientierung in
einem Teil des Ringes in Kauf nehmen zu müssen, gibt einen
schönen Einblick in die Peptid-
und Proteinchemie. Peptide und Proteine werden durch
 -Aminosäuren
gebildet und können intramolekulare C=O···H-N
Brücken bilden, die den N···H-O
Brücken in
-Aminosäuren
gebildet und können intramolekulare C=O···H-N
Brücken bilden, die den N···H-O
Brücken in  -Aminosäuren
sehr ähnlich sind. Diese intramolekularen
Wasserstoffbrücken sind für die großräumige
Struktur von Proteinen und Peptiden, und damit für ihre Funktion,
verantwortlich. Auf Grund des Bauprinzips der Peptidkette ist die
Ringgröße dabei auf einige wenige Werte beschränkt:
-Aminosäuren
sehr ähnlich sind. Diese intramolekularen
Wasserstoffbrücken sind für die großräumige
Struktur von Proteinen und Peptiden, und damit für ihre Funktion,
verantwortlich. Auf Grund des Bauprinzips der Peptidkette ist die
Ringgröße dabei auf einige wenige Werte beschränkt:
 -Helices
werden durch Wasserstoffbrücken stabilisiert, die einen
13-gliedrigen Ring schließen; es gibt
zwei verschiedene
-Helices
werden durch Wasserstoffbrücken stabilisiert, die einen
13-gliedrigen Ring schließen; es gibt
zwei verschiedene  -Helices:
-Helices: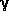 -turns,
die Knicke in der Peptidkette verursachen, entstehen durch einen
siebengliedrigen Ring;
-turns,
die Knicke in der Peptidkette verursachen, entstehen durch einen
siebengliedrigen Ring;
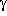 -turns
treten ebenfalls in zwei verschiedenen Formen,
up und down, auf, wie sie in
den Abbildungen neben diesem und dem vorangegangenen Absatz an Hand
des Modelltripeptides
-turns
treten ebenfalls in zwei verschiedenen Formen,
up und down, auf, wie sie in
den Abbildungen neben diesem und dem vorangegangenen Absatz an Hand
des Modelltripeptides

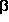 -turns
durch einen zehngliedrigen Ring
gebildet, dessen Größe auf Grund der Ergebnisse für
-turns
durch einen zehngliedrigen Ring
gebildet, dessen Größe auf Grund der Ergebnisse für
 -Aminosäuren
optimal für die Bildung der ringschließenden Wasserstoffbrücke
ist. Und tatsächlich gibt es mindestens zehn
verschiedene
-Aminosäuren
optimal für die Bildung der ringschließenden Wasserstoffbrücke
ist. Und tatsächlich gibt es mindestens zehn
verschiedene 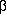 -turns, die für
eine Reihe von verschiedenen Sekundärstrukturelementen,
wie etwa das Haarnadelmotiv (Abbildung)
oder die
-turns, die für
eine Reihe von verschiedenen Sekundärstrukturelementen,
wie etwa das Haarnadelmotiv (Abbildung)
oder die 
 -Helix,
-Helix, -Aminohexansäure.
-Aminohexansäure.