Intramolekulare Wasserstoffbrücken in Aminoaldehyden.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Aminoaldehyden. |
|
 3-Aminopropanal ist eine Verbindung, die weit über
den Vergleich mit
3-Aminopropanal ist eine Verbindung, die weit über
den Vergleich mit  -Alanine und 3-Aminopropanol hinaus interessant
ist, nämlich weil es sie als stabile Substanz nicht gibt.
Zumindest gibt es keine experimentellen Resultate, abgesehen
von einigen Arbeiten über 3-Aminopropanal als Zwischenprodukt in
enzymatischen Reaktionen. Dieses praktische Nichtexistieren
einer eher kleinen organischen Verbindung ist umso bemerkenswerter,
als auf den ersten Blick keine besonderen
Probleme für Synthese oder Stabilität erkennbar sind.
-Alanine und 3-Aminopropanol hinaus interessant
ist, nämlich weil es sie als stabile Substanz nicht gibt.
Zumindest gibt es keine experimentellen Resultate, abgesehen
von einigen Arbeiten über 3-Aminopropanal als Zwischenprodukt in
enzymatischen Reaktionen. Dieses praktische Nichtexistieren
einer eher kleinen organischen Verbindung ist umso bemerkenswerter,
als auf den ersten Blick keine besonderen
Probleme für Synthese oder Stabilität erkennbar sind.
Die Ergebnisse der ab initio Berechnungen zeigen ein asymmetrisches globales Minimum, in dem die Aldehydgruppe fast koplanar mit der Ebene der drei Kohlenstoffatome ist. Die Aminogruppe ragt aus dieser Ebene heraus und bringt eines ihrer Wasserstoffatome in die Nähe des Sauerstoffatoms, ohne dabei aber eine Wasserstoffbrücke zu bilden.
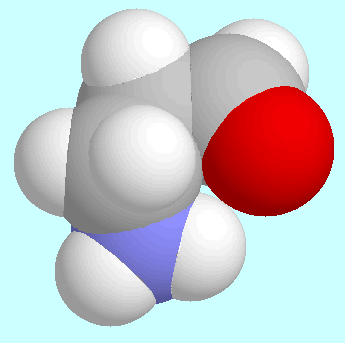
 Weitere interessante stationäre Punkte in der Potenzialfläche
von 3-Aminopropanal sind ein Konformer, in dem das
Wasserstoffatom der Aldehydgruppe zum Stickstoffatom hin orientiert
ist, und ein stationärer Punkt mit einer horizontalen Tangentialebene.
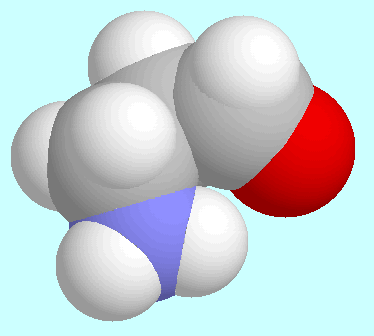
Das erstgenannte Konformer ist in der Abbildung neben diesem Absatz
gezeigt und ist deshalb bemerkenswert, weil die
C-H···N-Wechselwirkung
elektronisch repulsiv ist (die C-H-Bindung ist deutlich kürzer als
in allen anderen Konformeren, und die C-H-Schwingungsfrequenz liegt
mehr als 100 cm
Weitere interessante stationäre Punkte in der Potenzialfläche
von 3-Aminopropanal sind ein Konformer, in dem das
Wasserstoffatom der Aldehydgruppe zum Stickstoffatom hin orientiert
ist, und ein stationärer Punkt mit einer horizontalen Tangentialebene.
Das erstgenannte Konformer ist in der Abbildung neben diesem Absatz
gezeigt und ist deshalb bemerkenswert, weil die
C-H···N-Wechselwirkung
elektronisch repulsiv ist (die C-H-Bindung ist deutlich kürzer als
in allen anderen Konformeren, und die C-H-Schwingungsfrequenz liegt
mehr als 100 cm über dem Durchschnittswert).
über dem Durchschnittswert).
Offenbar
ist die elektrostatische Wechselwirkung zwischen dem positiv
geladenen Wasserstoff und dem negativ geladenen Stickstoff groß
genug um die elektronische Abstossung zu überwinden.
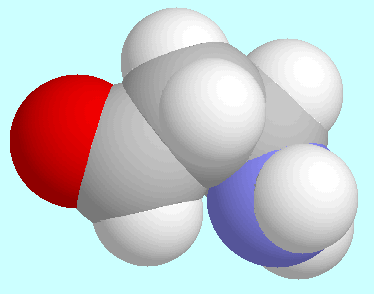
 Der oben angesprochene
stationäre Punkt der Potenzialfläche mit einer horizontalen
Tangentialebene ist neben diesem Absatz gezeigt. Seine Energie
ist ein Minimum bezüglich aller Freiheitsgrade außer
der Torsion der Aldehydgruppe; für diese steigt die Energie
in einer Richtung an, während sie in der anderen abnimmt.
Die nach der (für ein derartiges Potenzial kaum geeigneten)
harmonischen Näherung berechnete Schwingungsfrequenz beträgt
7,5 cm
Der oben angesprochene
stationäre Punkt der Potenzialfläche mit einer horizontalen
Tangentialebene ist neben diesem Absatz gezeigt. Seine Energie
ist ein Minimum bezüglich aller Freiheitsgrade außer
der Torsion der Aldehydgruppe; für diese steigt die Energie
in einer Richtung an, während sie in der anderen abnimmt.
Die nach der (für ein derartiges Potenzial kaum geeigneten)
harmonischen Näherung berechnete Schwingungsfrequenz beträgt
7,5 cm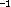 , was die stationäre Natur dieser
Anordnung bestätigt.
(Paul Mezey
hat für einen
, was die stationäre Natur dieser
Anordnung bestätigt.
(Paul Mezey
hat für einen
derartigen
Punkt einen guten Vergleich gegeben: er ist in einer bestimmten Art von
Wasserrutsche in manchen Freibädern verwirklicht.)
Solche Punkte können als Konformer angesehen werden, das für einen
Reaktionsweg keine Aktivierungsenergie benötigt.
Im Falle von 3-Aminopropanal ist diese Interpretation ein Omen für die gesamte Potenzialfläche, denn es gibt kein einziges Konformer mit nennenswerter kinetischer Stabilität. Für jedes Konformer gibt es mindestens einen Pfad mit sehr geringer Potenzialbarriere; das kinetisch stabilste Konformer ist das globale Minimum mit einer kleinsten Barriere von etwa 1 kcal/mol, was der thermischen Energie bei Raumtemperatur entspricht. Das scheint auch die Erklärung zu sein, warum 3-Aminopropanal so instabil ist:
 -Alanin.
-Alanin.