Intramolekulare Wasserstoffbrücken in Hydroxysäuren.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Hydroxysäuren. |
|
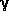 -Hydroxybuttersäure
gehört zu jenen Verbindungen, die in der Lage sind, die
Barriere zwischen Blut und Gehirn zu passieren. Diese physiologische
Bedeutung hat ihr die Abkürzung "GHB" eingetragen. GHB wird im Gehirn von
Säugetieren synthetisiert und in
bestimmte Nervenbahnen mit neuromodulatorischen Funktionen
ausgeschüttet; die Synthese geht von
-Hydroxybuttersäure
gehört zu jenen Verbindungen, die in der Lage sind, die
Barriere zwischen Blut und Gehirn zu passieren. Diese physiologische
Bedeutung hat ihr die Abkürzung "GHB" eingetragen. GHB wird im Gehirn von
Säugetieren synthetisiert und in
bestimmte Nervenbahnen mit neuromodulatorischen Funktionen
ausgeschüttet; die Synthese geht von 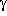 -Aminobuttersäure (GABA)
oder 1,4-Butandiol als Vorläufersubstanzen
aus. GHB kann auch in der Leber von Säugetieren aus
-Aminobuttersäure (GABA)
oder 1,4-Butandiol als Vorläufersubstanzen
aus. GHB kann auch in der Leber von Säugetieren aus
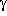 -Butyrolacton
synthetisiert werden. GHB wurde z. B.
zur Behandlung von Alkoholsüchtigen eingesetzt.
In den letzten Jahren hat GHB allerdings als
Bestandteil von
Partydrogen Furore gemacht.
-Butyrolacton
synthetisiert werden. GHB wurde z. B.
zur Behandlung von Alkoholsüchtigen eingesetzt.
In den letzten Jahren hat GHB allerdings als
Bestandteil von
Partydrogen Furore gemacht.
|
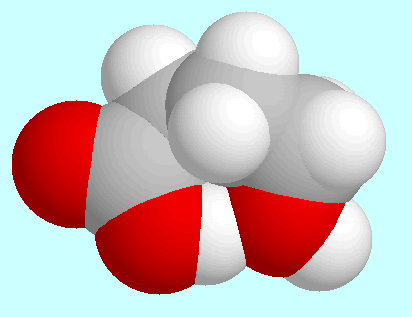
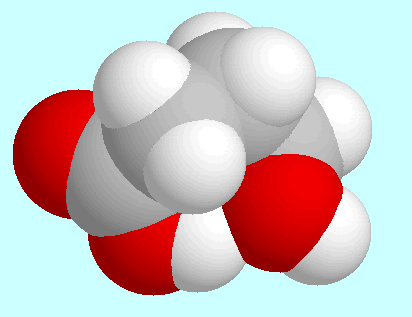
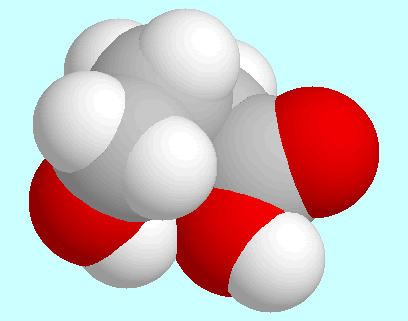
Hinsichtlich intramolekularer Wechselwirkungen sind vor allem
die drei symmetrie-eindeutigen Konformere mit einer
Wasserstoffbrücke
(CO)O-H···O-H zu nennen, die über diesem
Absatz in energetisch ansteigender Reihenfolge gezeigt sind.
Das stabilste dieser Konformere (A) hat eine Geometrie vom Umschlag-Typ: die
COOH-Gruppe, die Kohlenstoffatome  und
und 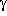 sowie die aliphatische
OH-Gruppe liegen annähernd in einer Ebene, aus der das Kohlenstoffatom
sowie die aliphatische
OH-Gruppe liegen annähernd in einer Ebene, aus der das Kohlenstoffatom
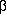 herausragt.
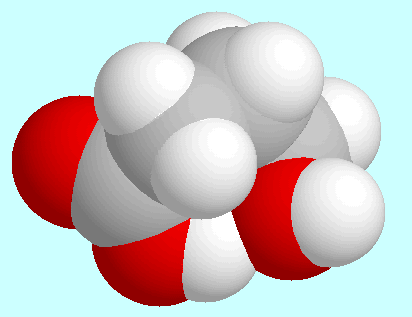
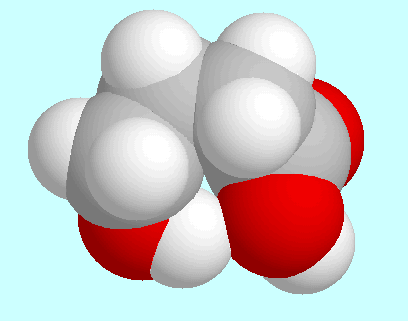
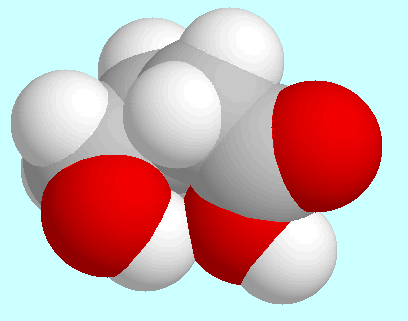
Die beiden anderen Konformere (B und C) weisen eine Art Wannen-Struktur auf und
unterscheiden sich nur durch die Anordnung der OH-Gruppe; die
Wasserstoffbrückenbindung ist in beiden schwächer als in A,
wie gut an den verschieden starken Überlappungen
der entsprechenden Kalotten zu sehen ist.
Zwischen diesen drei Konformeren und ihren Enantiomeren
(a, b und c) besteht das im folgenden Schema gezeigte
Netzwerk von Reaktionen, in denen die Wasserstoffbrückenbindung
erhalten bleibt.
herausragt.
Die beiden anderen Konformere (B und C) weisen eine Art Wannen-Struktur auf und
unterscheiden sich nur durch die Anordnung der OH-Gruppe; die
Wasserstoffbrückenbindung ist in beiden schwächer als in A,
wie gut an den verschieden starken Überlappungen
der entsprechenden Kalotten zu sehen ist.
Zwischen diesen drei Konformeren und ihren Enantiomeren
(a, b und c) besteht das im folgenden Schema gezeigte
Netzwerk von Reaktionen, in denen die Wasserstoffbrückenbindung
erhalten bleibt.
 Wie in den anderen Hydroxy- und Aminosäuren ist keines dieser
wasserstoffbrückengebundenen Konformere das globale Minimum der
Potenzialfäche, da die trans-Orientierung der COOH-Gruppe
energetisch ungünstig ist. Für GHB ergibt eine numerische
Abschätzung der cis-trans-Energiedifferenz 35,3 kJ/mol,
für die Stabilisierung durch die Wasserstoffbrücke dagegen
Werte von 34,9, 23,9 und 23,5 kJ/mol.
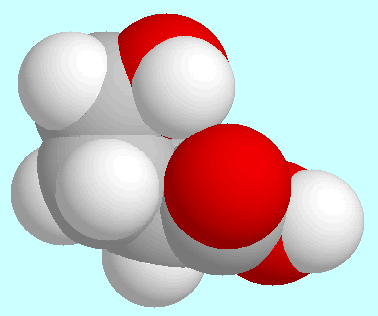
Die Struktur des
globalen Minimums ist am Beginn dieses Absatzes gezeigt; die COOH-Gruppe
und die Kohlenstoffatome
Wie in den anderen Hydroxy- und Aminosäuren ist keines dieser
wasserstoffbrückengebundenen Konformere das globale Minimum der
Potenzialfäche, da die trans-Orientierung der COOH-Gruppe
energetisch ungünstig ist. Für GHB ergibt eine numerische
Abschätzung der cis-trans-Energiedifferenz 35,3 kJ/mol,
für die Stabilisierung durch die Wasserstoffbrücke dagegen
Werte von 34,9, 23,9 und 23,5 kJ/mol.
Die Struktur des
globalen Minimums ist am Beginn dieses Absatzes gezeigt; die COOH-Gruppe
und die Kohlenstoffatome  und
und
 sind dabei nahezu
koplanar, das Kohlenstoffatom
sind dabei nahezu
koplanar, das Kohlenstoffatom  ragt aus dieser Ebene heraus, und die aliphatische
OH-Gruppe ist zum Carbonylsauerstoffatom hin orientiert.
In der O-H···O=C-Wechselwirkung, die daraus resultiert,
beträgt der H···O-Abstand 2,33 Å und ist damit etwas
länger als im vergleichbaren Konformer der
ragt aus dieser Ebene heraus, und die aliphatische
OH-Gruppe ist zum Carbonylsauerstoffatom hin orientiert.
In der O-H···O=C-Wechselwirkung, die daraus resultiert,
beträgt der H···O-Abstand 2,33 Å und ist damit etwas
länger als im vergleichbaren Konformer der  -Hydroxypropionsäure.
Die Elektronendichte kennzeichnet diese Wechselwirkung
nicht als Wasserstoffbrückenbindung sondern als elektrostatische Anziehung.
-Hydroxypropionsäure.
Die Elektronendichte kennzeichnet diese Wechselwirkung
nicht als Wasserstoffbrückenbindung sondern als elektrostatische Anziehung.
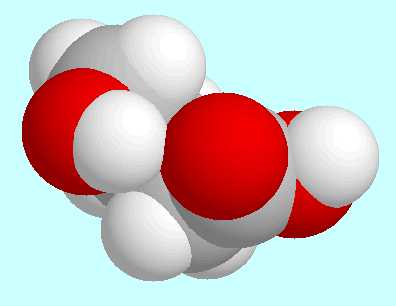
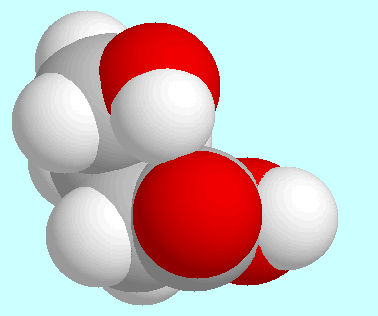 Im Gegensatz dazu ist diese Wechselwirkung in den beiden
Konformeren, die links und rechts neben diesem Absatz wiedergegeben sind,
und ihren Analoga mit trans-Orientierung der COOH-Gruppe
eine schwache Wasserstoffbrücke
(Bindungsordnungen: 0,030 und 0,025).
Im Gegensatz dazu ist diese Wechselwirkung in den beiden
Konformeren, die links und rechts neben diesem Absatz wiedergegeben sind,
und ihren Analoga mit trans-Orientierung der COOH-Gruppe
eine schwache Wasserstoffbrücke
(Bindungsordnungen: 0,030 und 0,025).
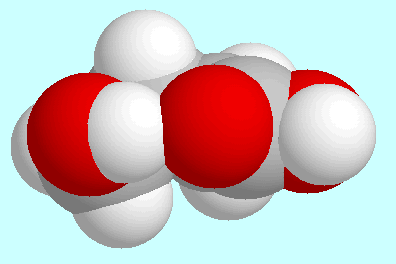 Eine deutlich stärkere Form dieser
O-H···O=C-Wasserstoffbrückenbindung
(mit einer Bindungsordnung von 0,044)
wird in einem anderen Konformer ausgebildet. Die Geometrie dieses Konformeren
ist neben diesem Absatz gezeigt und kann als leicht verzerrter Umschlag-Typ
(mit Kohlenstoffatom
Eine deutlich stärkere Form dieser
O-H···O=C-Wasserstoffbrückenbindung
(mit einer Bindungsordnung von 0,044)
wird in einem anderen Konformer ausgebildet. Die Geometrie dieses Konformeren
ist neben diesem Absatz gezeigt und kann als leicht verzerrter Umschlag-Typ
(mit Kohlenstoffatom  außerhalb
der Ebene) beschrieben werden. In diesem Fall ist auch eine energetische
Auswirkung nicht von der Hand zu weisen, denn dieses Konformer
ist das energetisch dritte (von insgesamt 66 symmetrie-eindeutigen Konformeren)
in der GHB-Potenzialfläche.
außerhalb
der Ebene) beschrieben werden. In diesem Fall ist auch eine energetische
Auswirkung nicht von der Hand zu weisen, denn dieses Konformer
ist das energetisch dritte (von insgesamt 66 symmetrie-eindeutigen Konformeren)
in der GHB-Potenzialfläche.
Hinsichtlich intramolekularer Wasserstoffbrücken sind weiters noch drei Konformere mit cis-Anordnung der COOH-Gruppe zu erwähnen, in denen eine schwache O-H···(CO)O-H-Wasserstoffbrücke gebildet wird. Diese Konformere sind unter diesem Absatz abgebildet; für das in der Mitte gezeigte existiert auch ein hochenergetisches Analogon mit trans-Orientierung der COOH-Gruppe.
|
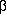 -Hydroxypropionsäure.
-Hydroxypropionsäure.
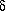 -Hydroxypentansäure.
-Hydroxypentansäure.